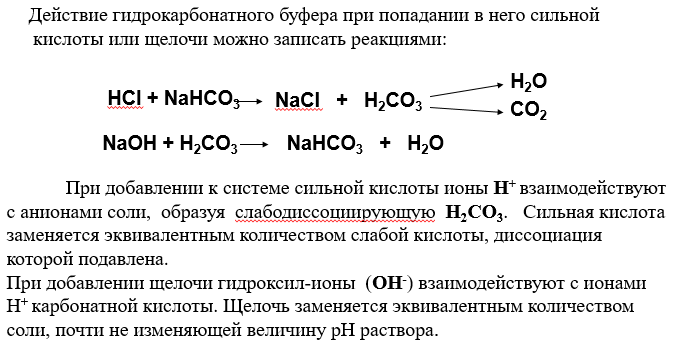
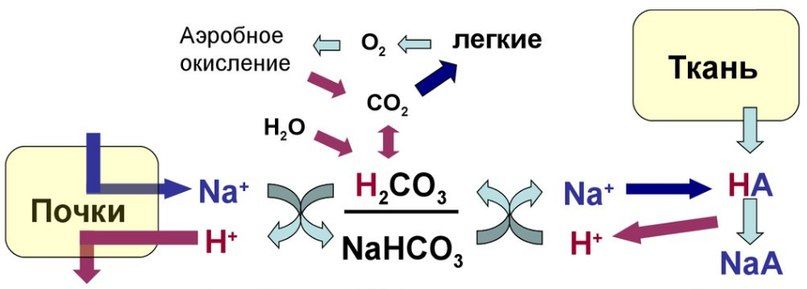
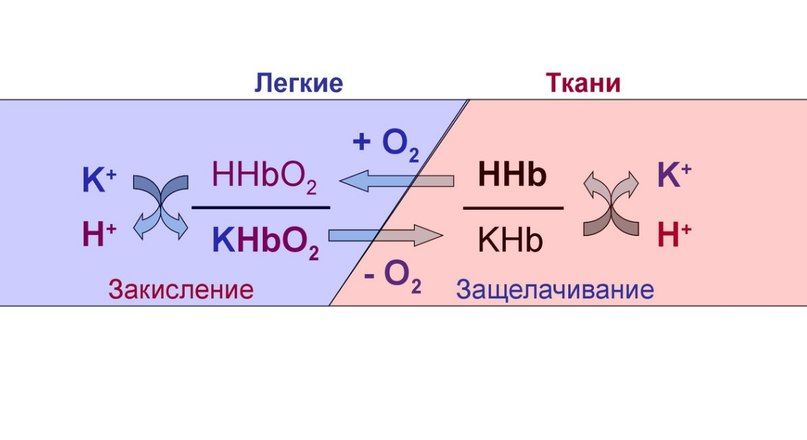
4. Механизм буферного действия (на примере аммиачного буфера)
В растворе устанавливаются равновесия:. Каждое из этих равновесий характеризуется своей константой: первое — ионным произведением воды , второе — константой диссоциации кислоты. Значение pH буферных растворов можно рассчитать по уравнению Гендерсона :. Буферные растворы сохраняют своё действие только до определённого количества добавляемой кислоты, основания или степени разбавления, что связано с изменением концентраций его компонентов. Способность буферного раствора сохранять свой pH определяется его буферной ёмкостью — количеством сильной кислоты или основания, которые следует прибавить к 1 л буферного раствора, чтобы его pH изменился на единицу.








Лекции Буферные системы. Буферные системы — совокупность нескольких веществ в растворе, сообщающих ему буферные свойства, то есть способность противостоять изменению активной реакции среды pH при разбавлении, концентрировании раствора или при добавлении к нему небольших количеств сильной кислоты или щёлочи. Буферные системы широко распространены в природе: они находятся в водах мирового океана, почвенных водах и особенно в живых организмах, где выступают в качестве регуляторов, поддерживающих активную реакцию среды на определённых условиях, необходимых для нормального протекания жизненных процессов. Буферные системы обеспечивают состояние кислотно-основного равновесия, соответствующего норме — протолитический гомеостаз. Смещение протолитического равновесия в кислую область вызывает ацидоз, в щелочную — алкалоз. Постоянство pH биологических жидкостей, тканей и органов обусловлено наличием нескольких буферных систем, входящих в состав этих биообъектов.
- Блог группы PCC
- Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
- В присутствии второго компонента буферного раствора — сильного электролита — равновесие диссоциации слабой кислоты НA, согласно принципу Ле Шателье, смещено влево. Поэтому можно считать, что концентрация недиссоциированных молекул НA практически равна концентрации кислоты в буферном растворе, а концентрация ионов A - равна концентрации соли.
- Лекции Буферные системы. Буферные системы — совокупность нескольких веществ в растворе, сообщающих ему буферные свойства, то есть способность противостоять изменению активной реакции среды pH при разбавлении, концентрировании раствора или при добавлении к нему небольших количеств сильной кислоты или щёлочи.
- Аммонийная буферная система
- Буферные системы — совокупность нескольких веществ в растворе , сообщающих ему буферные свойства, то есть способность противостоять изменению активной реакции среды pH при разбавлении, концентрировании раствора или при добавлении к нему небольших количеств сильной кислоты или щёлочи. Буферные системы широко распространены в природе: они находятся в водах мирового океана, почвенных водах и особенно в живых организмах, где выступают в качестве регуляторов, поддерживающих активную реакцию среды на определённых условиях, необходимых для нормального протекания жизненных процессов.
- Effective date :
- При разбавлении водой происходит уменьшение концентрации обоих компонентов в буферной системе в одинаковой степени, поэтому величина их соотношения не изменится.




Вы точно человек?
С соли. Буферное действие прекращается, как только одна из составных частей буферного раствора сопряженное основание или сопряженная кислота полностью израсходуется. Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью. По мере увеличения концентрации буферного раствора возрастает его способность сопротивляться изменению рН при добавлении кислот или щелочей.